Selon le mode de connexion des acides aminés et du sucre, le peptide de sucre peut être divisé en quatre catégories : O glycosylation, C a N glycosylation, saccharification par rosée et connexion GPI (glycophosphatidlyinositol).
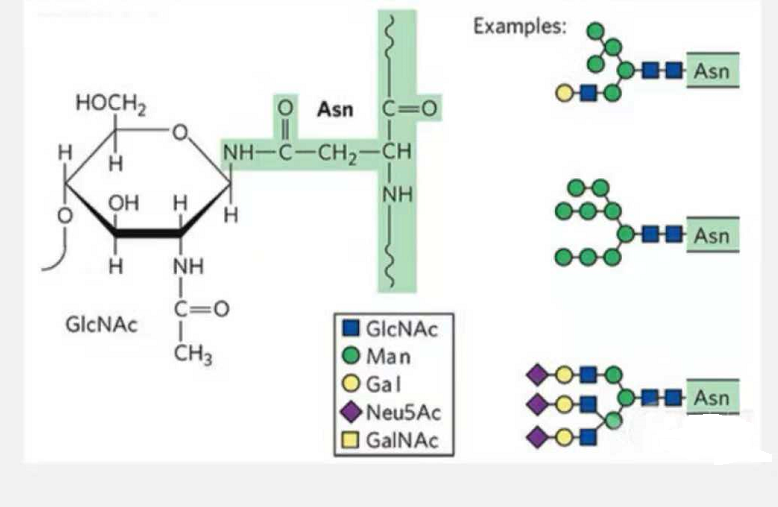
1. Les glycopeptides de N-glycosylation sont composés de N-acétamide glucose à l'extrémité réductrice de la chaîne glycane (Glc-Nac) lié à l'atome N sur le groupe amide de la chaîne latérale de certains Asn dans la chaîne peptidique, et de l'Asn capable de lier la chaîne glycane doit être localisé dans l'AsN-X-Ser /Thr (X! =P) dans le motif formé par les résidus.Le sucre est la N-acétylglucosamine.
Glycopeptide structurel modifié par N-glycosylation
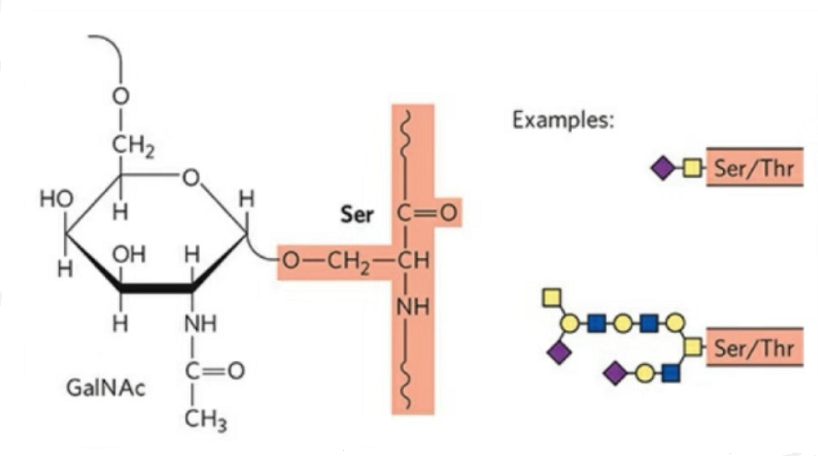
2. La structure de la O-glycosylation est plus simple que celle de la N-glycosylation.Ce glycopeptide est généralement plus court que le glycane, mais possède plus de types que la N-glycosylation.Ser et Thr peuvent généralement être glycosylés dans la chaîne peptidique.De plus, il existe des glycopeptides décorés par glycosylation de la tyrosine, de l'hydroxyle et de l'hydroxyproline.La position du lien est l’atome d’oxygène hydroxyle sur la chaîne latérale du résidu.Les sucres liés sont le galactose ou la N-acétylgalactosamine (Gal&GalNAc) ou le glucose/glucosamine (Glc/GlcNAc), le mannose/mannosamine (Man/ManNAc), etc.
La O-glycosylation modifie la structure
3. Glycopeptide O-GlcNAC glycosylation ((N-acétylcystéine (NAC)) (glcnAcN-acétylglucosamine/acétylglucosamine)
Une seule glycosylation de N-acétylglucosamine (GlcNAc) relie les protéines O-GlcNAc à l'atome d'oxygène hydroxyle du résidu sérine ou thréonine d'une protéine.La glycosylation de l'O-GlcNA est un ornement de monosaccharide O-GlcNAc sans extension glycane ;Comme la phosphorylation des peptides, la glycosylation O-GlcNAc des glycopeptides est également un processus dynamique de décoration des protéines.Une décoration anormale en O-GlcNAc peut provoquer diverses maladies telles que le diabète, les maladies cardiovasculaires, les tumeurs, la maladie d'Alzheimer, etc.
Points de glycosylation des glycopeptides
Les structures de base des chaînes polypeptidiques et sucrées sont liées aux chaînes protéiques par des liaisons covalentes, et les sites reliant les chaînes sucrées sont appelés sites de glycosylation.Puisqu’il n’existe aucun modèle pour suivre la biosynthèse des chaînes de sucres glycopeptidiques, différentes chaînes de sucres seront attachées au même site de glycosylation, conduisant à ce que l’on appelle l’inhomogénéité microscopique.
Glycosylation des glycopeptides
1. Effet de la glycosylation des glycopeptides sur l’efficacité thérapeutique des protéines thérapeutiques
Dans le cas des protéines thérapeutiques, la glycosylation affecte également la demi-vie et le ciblage des médicaments protéiques in vivo.
2. Glycosylation des glycopeptides solubles et protéines
Des études ont montré que les chaînes de sucre à la surface des protéines peuvent améliorer la solubilité moléculaire des protéines.
3. Glycopeptide glycosylation et immunogénicité des protéines
D’une part, les chaînes de sucres à la surface des protéines peuvent induire des réponses immunitaires spécifiques.D’un autre côté, les chaînes de sucre peuvent recouvrir certaines surfaces de la surface des protéines et réduire son immunogénicité.
4. Glycopeptide glycosylation qui augmente la stabilité des protéines
La glycosylation peut augmenter la stabilité des protéines face à diverses conditions de dénaturation (telles que les dénaturants, la chaleur, etc.) et éviter l'agrégation des protéines.Dans le même temps, les chaînes de sucre à la surface des protéines peuvent également couvrir certains points de dégradation protéolytique des molécules protéiques, augmentant ainsi la résistance des protéines aux protéases.
5. Glycopeptide glycosylation qui affecte l'activité biologique des molécules protéiques
La modification de la glycosylation des protéines peut également permettre aux molécules protéiques de former de nouvelles activités biologiques
Heure de publication : 03 août 2023