Transfert d'énergie par résonance de fluorescence (FRET)
Le transfert d'énergie par résonance de fluorescence (FRET) est un processus de transfert d'énergie non radiatif dans lequel l'énergie de l'état excité du donneur est transférée à l'état excité de l'accepteur par l'interaction de couples électriques intermoléculaires.Ce processus n'implique pas de photons et est donc non radiatif.Ce test présente les avantages d’être rapide, sensible et simple.
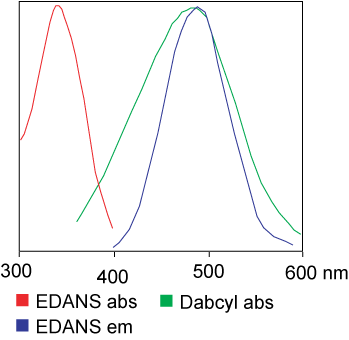
Le colorant utilisé dans le test FRET peut être identique.Mais dans la plupart des applications, différents colorants sont en réalité utilisés.En bref, le transfert d'énergie de résonance lumineuse est le transfert d'une paire de dipôles du donneur (colorant 1) vers l'accepteur (colorant 2) lorsque le groupe donneur est excité.En général, le spectre d'émission du groupe fluorophore donneur chevauche le spectre d'absorption du groupe accepteur."Lorsque la distance entre les deux fluorophores est appropriée (10 à 100 A), le transfert d'énergie du fluorophore du donneur vers l'accepteur peut être observé."La méthode de transfert d'énergie dépend de la structure chimique du récepteur :
1. Est converti en vibration moléculaire, c'est-à-dire que la lumière lumineuse du transfert d'énergie disparaît.(Le récepteur est un extincteur de lumière)
2. L’émission est plus intense que le récepteur lui-même, ce qui entraîne un redshift dans le spectre de fluorescence secondaire.(Les récepteurs sont des émetteurs lumineux).
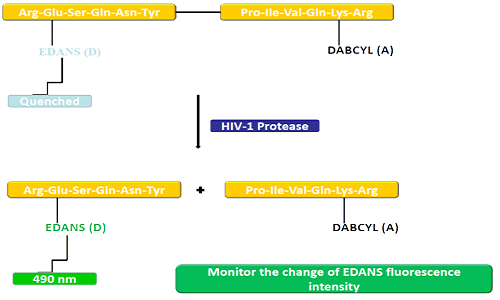
Le groupe donneur (EDANS) et le gène accepteur (DABCYL) sont uniformément liés au substrat naturel de la protéase du VIH, et lorsque le substrat n'est pas déconnecté, DABCYL peut éteindre l'EDANS et devenir alors indétectable au fluor.Lors de la déconnexion de la protéase du VIH-1, EDANS n'est plus désactivé par DABCYL et les luciférases EDANS peuvent ensuite être détectées.La disponibilité des inhibiteurs de protéase peut être surveillée par des changements dans l'intensité de fluorescence de l'EDANS.
Les peptides FRET sont des outils pratiques pour étudier la non-spécificité de la peptidase.Puisque son processus de réaction peut être surveillé en permanence, il constitue une méthode pratique pour détecter l’activité enzymatique.L'éclat produit après l'hydrolyse des liaisons peptidiques par le donneur/accepteur fournit une mesure de l'activité enzymatique à des concentrations nanomolaires.Lorsque le peptide FRET est intact, il présente une disparition soudaine du flash interne, mais lorsqu'une liaison peptidique opposée au donneur/accepteur se rompt, il libère un flash, qui peut être détecté en continu et l'activité enzymatique peut alors être quantifiée.
Heure de publication : 14 août 2023