Les dernières données cliniques de phase II de Novo Nordisk montrent que l'amycrétine, un double agoniste à molécule unique GLP-1 + amyline, a montré des effets positifs chez les patients obèses et diabétiques de type 2.
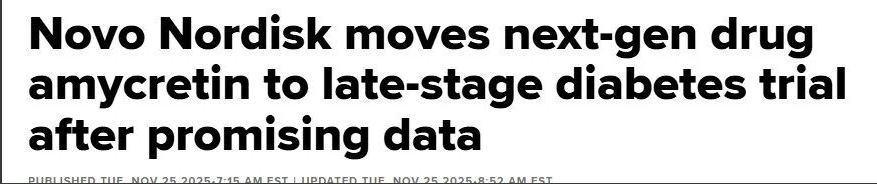


Introduction de base Nom chinois : peptide de type glucagon (GLP-1) et polypeptide agoniste des récepteurs de l'amyline Nom anglais : amycrétine/zenagamtide Numéro de société : gt-l020/gt-m16083cas No : 3005889-81-3séquence :H-His- {AIB} -Glu-Gly-PH-Ser-Glun-Glun-Glun-Glun-Glun-Glun-Glun-Gl- A)} - gly-gly-gly-gl-gl-day-gl-ped-gl-gl-dur-gl-gl-gl-gl-gl-gl-gl-gl-glink-gl- Formule moléculaire : C343H50N94O116poids moléculaire : 7846,5753
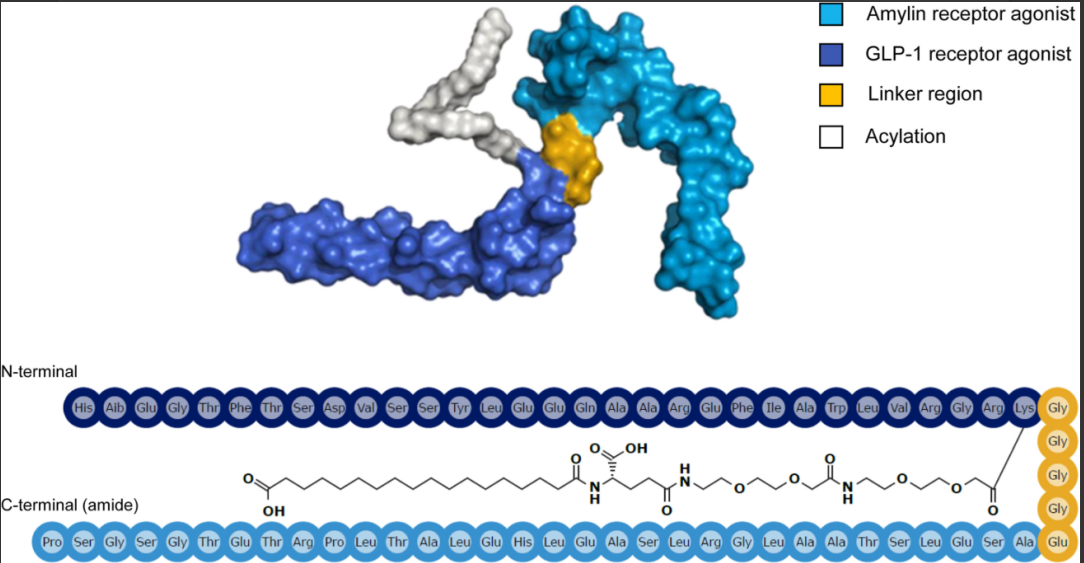
Formule de structure chimique deUNmycrétine
Potentiel de perte de poids
Injection sous-cutanée une fois par semaine, perte de poids allant jusqu'à 14,5 % en 36 semaines et aucun plateau d'effet curatif n'a été observé.
Points forts des préparations orales
L'administration orale quotidienne d'amycrétine a également montré de bons effets, l'HbA1c diminuant jusqu'à 1,5 %.
Si une validation plus approfondie aboutit, il devrait devenir un autre médicament oral GLP-1 pouvant être utilisé pour perdre du poids après l'agent oral smeglutide, offrant ainsi des options plus flexibles aux patients.
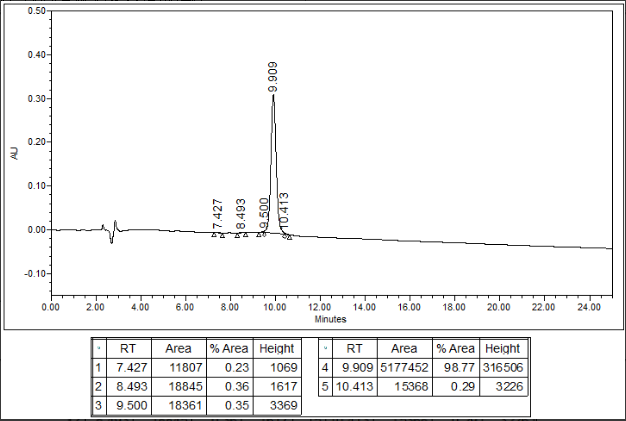
Amycrétine HPLC
Observation de sécurité
Les données cliniques actuelles montrent que la sécurité est cohérente avec le traitement existant par le glp-1/amyline, principalement en cas de réactions gastro-intestinales légères à modérées.
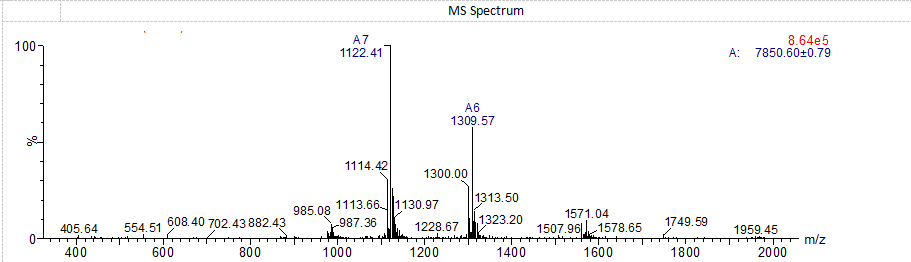
Amycrétine MS
Signification clinique
Il s'agit de la première évaluation systématique de l'amycrétine chez des patients atteints de diabète sucré de type 2. Les résultats montrent que son effet de perte de poids est significatif ainsi que le potentiel de flexibilité bimode oral + injection.
Si la validation clinique de suivi réussit, il devrait entrer dans les essais cliniques de phase 3.
Avertissement : cet article est une étude d'échange industriel. Le droit d'auteur appartient à l'auteur original. S'il y a infraction, vous pouvez contacter pour la supprimer
Heure de publication : 2025-12-01
