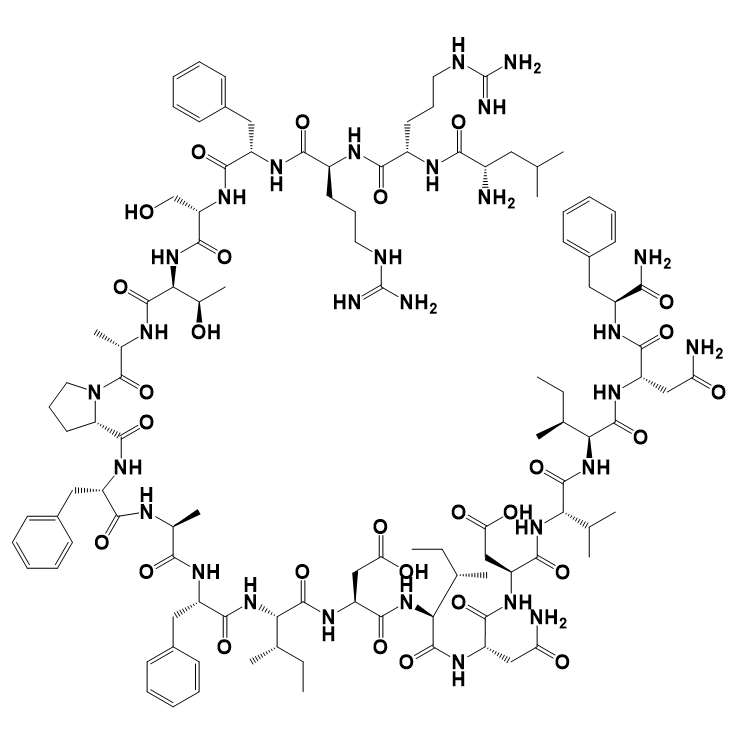
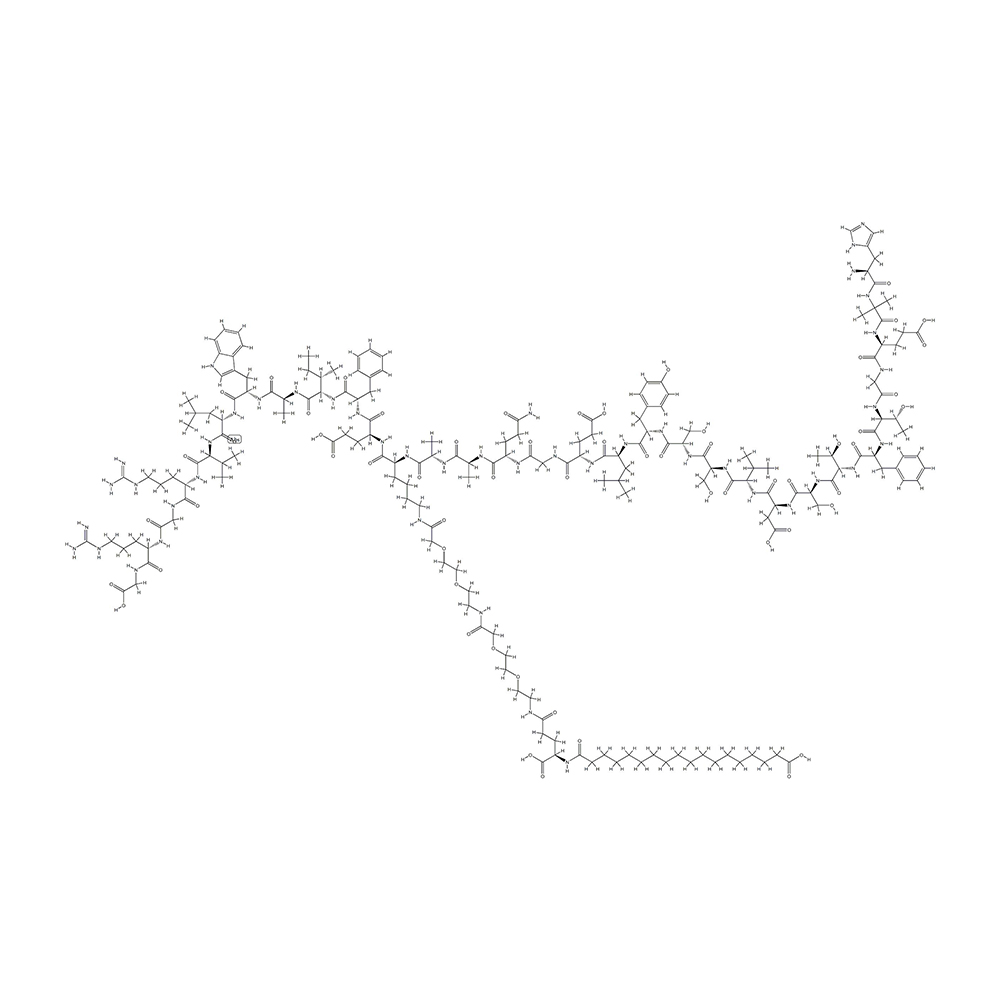
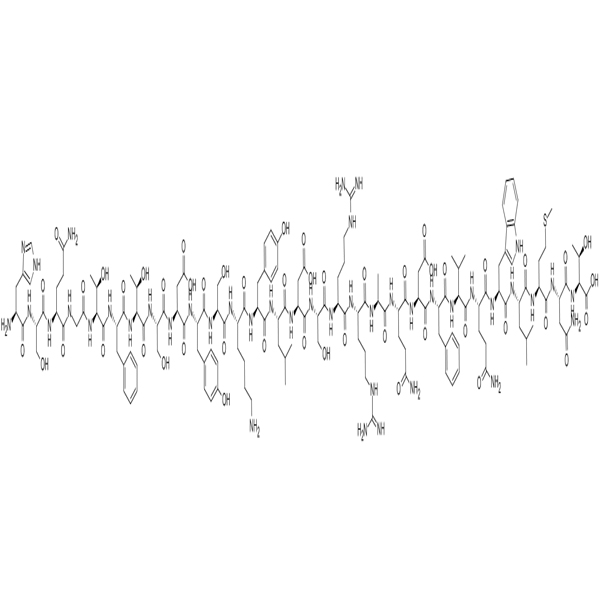
LAE102 Synthèse du fournisseur / peptide / vendeur chinois
LAE102 est un anticorps monoclonal visant à traiter l'obésité, ciblant sélectivement le récepteur de l'ACTRIIA, qui joue un rôle crucial dans la régénération musculaire et le métabolisme des lipides. Actuellement, LAE102 a montré un potentiel dans les modèles précliniques pour augmenter la masse maigre et réduire la masse grasse. De plus, lorsqu'il est utilisé en conjonction avec les agonistes de GLP1R, LAE102 peut réduire davantage la masse grasse et restaurer considérablement la perte de masse maigre causée par les agonistes de GLP1R, ce qui en fait un candidat de médicament prometteur pour obtenir un contrôle de poids efficace.
Caractéristiques
Apperance: poudre blanche à blanc cassé
Pureté (HPLC): ≥98.0%
Impureté unique: ≤2.0%
Contenu en acétate (HPLC): 5,0%~12.0%
Contenu en eau (Karl Fischer): ≤10.0%
Contenu du peptide: ≥80.0%
Emballage et expédition: basse température, emballage à vide, précis à MG au besoin.
FAQ:
Quelle fin est la meilleure pour mes recherches?
Par défaut, le peptide se termine par un groupe amino libre N-terminal et un groupe carboxyle sans terminal C-terminal. La séquence peptidique représente souvent la séquence de la protéine mère. Afin d'être plus proche de la protéine mère, la fin du peptide doit souvent être fermée, c'est-à-dire l'acétylation N-terminale et l'amidation C-terminale. Cette modification évite l'introduction d'une charge excessive, et la rend également plus en mesure d'empêcher l'action exonucliale, afin que le peptide soit plus stable.
Comment dissoudre les polypeptides?
La solubilité du polypeptide dépend principalement de sa structure primaire et secondaire, la nature de l'étiquette de modification, le type de solvant et la concentration finale. Si le peptide est insoluble dans l'eau, l'échographie peut aider à la dissoudre. Pour le peptide de base, il est recommandé de se dissoudre avec 10% d'acide acétique; Pour les peptides acides, la dissolution avec 10% NH4HCO3 est recommandée. Des solvants organiques peuvent également être ajoutés aux polypeptides insolubles. Le peptide est dissous dans le moins de solvant organique (par exemple, DMSO, DMF, alcool isopropylique, méthanol, etc.). Il est fortement recommandé que le peptide soit dissous dans le solvant organique d'abord, puis ajouté lentement à l'eau ou à un autre tampon jusqu'à la concentration souhaitée.
Quelle longueur de peptide est appropriée?
La synthèse des peptides doit prendre en compte des facteurs tels que la longueur, la charge et l'hydrophilie du peptide. Plus la longueur, la pureté et le rendement du produit synthétique brut diminuent, et la difficulté de purification et le risque de non-synthèse seront plus importantes. Bien sûr, la séquence de la région fonctionnelle du polypeptide ne peut pas être modifiée, mais pour la synthèse fluide du polypeptide, parfois certains acides aminés auxiliaires doivent être ajoutés à l'amont et en aval de la prise fonctionnelle pour améliorer la solubilité et l'hydrophilie du polypeptide. Si le polypeptide est trop court, il peut également y avoir des problèmes de synthèse, le principal problème est que le polypeptide synthétique a une certaine difficulté dans le processus de post-traitement, et le polypeptide inférieur à 5 peptides a généralement des acides aminés hydrophobes, sinon le post-traitement est plus difficile. Les peptides inférieurs à 15 résidus d'acides aminés ont généralement des rendements et des rendements satisfaisants.
À quoi dois-je prêter attention lors de l'introduction de modifications fluorescentes en peptides?
Il est recommandé d'ajouter un lieur entre la molécule peptidique et la modification fluorescente, ce qui peut réduire l'effet de la modification fluorescente sur le repliement et la liaison du peptide au récepteur. Cependant, si le but de la modification de la fluorescence est de quantifier la migration de fluorescence entre différentes structures, l'introduction d'un linker n'est pas recommandée.
Pourquoi les peptides devraient-ils être modifiés par acétylation N-terminale et amidation C-terminale?
De telles modifications peuvent donner des propriétés de séquences peptidiques originaires de protéines.