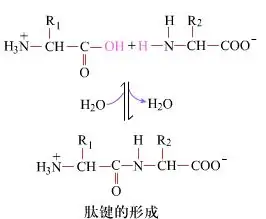
En surface, la formation de liaisons peptidiques, produisant des dipeptides, est un processus chimique simple. Cela signifie que les deux composants d'acides aminés sont liés par une liaison peptidique, une liaison amide, tout en étant déshydratée.
La formation de liaison peptidique est l'activation d'un acide aminé dans des conditions de réaction légères. (A) Fessage carboxyle, deuxième acide aminé (b) Le fragment carboxyle activé nucléophile forme ensuite le dipeptide (A-B). «Si le composant carboxyle (a) n'est pas protégé, la formation de la liaison peptidique ne peut pas être contrôlée.» Des sous-produits tels que les peptides linéaires et cycliques peuvent être mélangés avec des composés cibles A-B. Par conséquent, tous les groupes fonctionnels non impliqués dans la formation de liaisons peptidiques doivent être protégés de manière temporairement réversible pendant la synthèse des peptides.
Ainsi, la synthèse des peptides - la formation de chaque liaison peptidique - implique trois étapes d'agrégation.
La première étape consiste à préparer certains acides aminés qui nécessitent une protection, et la structure zwitterionique des acides aminés n'existe plus.
La deuxième étape est une réaction en deux étapes pour former des liaisons peptidiques, dans lesquelles le groupe carboxyle de l'acide aminé protégé par N est d'abord activé à l'intermédiaire actif, puis la liaison peptidique est formée. Cette réaction couplée peut se produire soit en tant que réaction en une étape, soit comme deux réactions séquentielles.
La troisième étape est l'élimination sélective ou le retrait complet de la base de protection. Bien que toute élimination ne puisse se produire qu'après que toutes les chaînes peptidiques ont été assemblées, l'élimination sélective des groupes de protection est également nécessaire afin de poursuivre la synthèse des peptides.
Parce que 10 acides aminés (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec et Cys) contiennent des groupes fonctionnels de la chaîne latérale, qui nécessitent une protection sélective, ce qui rend la synthèse des peptides plus compliquée. Les bases de protection temporaires et semi-permanentes doivent être distinguées en raison des différentes exigences de sélectivité. Des groupes de protection temporaire sont utilisés à l'étape suivante pour refléter la protection temporaire des groupes fonctionnels acides ou carboxyle. Les groupes de protection semi-permanents sont éliminés sans interférer avec des liaisons peptidiques déjà formées ou des chaînes latérales d'acides aminés, parfois pendant la synthèse.
«Idéalement, l'activation de la composante carboxyle et la formation ultérieure de liaisons peptidiques (réactions de couplage) doivent être rapides, sans formation de racémique ou de sous-produit, et les réactifs molaires doivent être appliqués pour obtenir des rendements élevés.» Malheureusement, aucune des méthodes de couplage chimique ne satisfait à ces exigences, et peu conviennent à la synthèse pratique.
Pendant la synthèse des peptides, les groupes fonctionnels impliqués dans diverses réactions sont généralement liés au centre manuel, la glycine étant la seule exception, et il existe un risque potentiel de rotation.
La dernière étape du cycle de synthèse du peptide est l'élimination de tous les groupes de protection. L'élimination sélective des groupes de protection est importante pour l'extension de la chaîne peptidique en plus de l'exigence d'une élimination complète de la protection dans la synthèse du dipeptide. Les stratégies synthétiques doivent être soigneusement planifiées. Selon le choix stratégique, N peut supprimer sélectivement les groupes de protection α-amino ou carboxyle. Le terme «stratégie» fait référence à la séquence des réactions de condensation des acides aminés individuels. En général, il existe une différence entre la synthèse progressive et la condensation des fragments. La synthèse des peptides (également connue sous le nom de «synthèse conventionnelle») a lieu en solution. Dans la plupart des cas, l'allongement progressif de la chaîne peptidique ne peut être synthétisé qu'en utilisant la chaîne peptidique pour synthétiser des fragments plus courts. Pour synthétiser des peptides plus longs, les molécules cibles doivent être segmentées en fragments appropriés et déterminé qu'ils peuvent minimiser le degré de différenciation à l'extrémité C. Une fois que les fragments individuels sont progressivement assemblés, le composé cible sera rejoint. La stratégie de synthèse des peptides comprend la sélection du fragment protecteur le meilleur et le plus approprié, et la stratégie de synthèse des peptides comprend la sélection de la combinaison la plus appropriée de bases de protection et la meilleure méthode de conjugaison de fragments.
Heure du poste: 2025-07-02