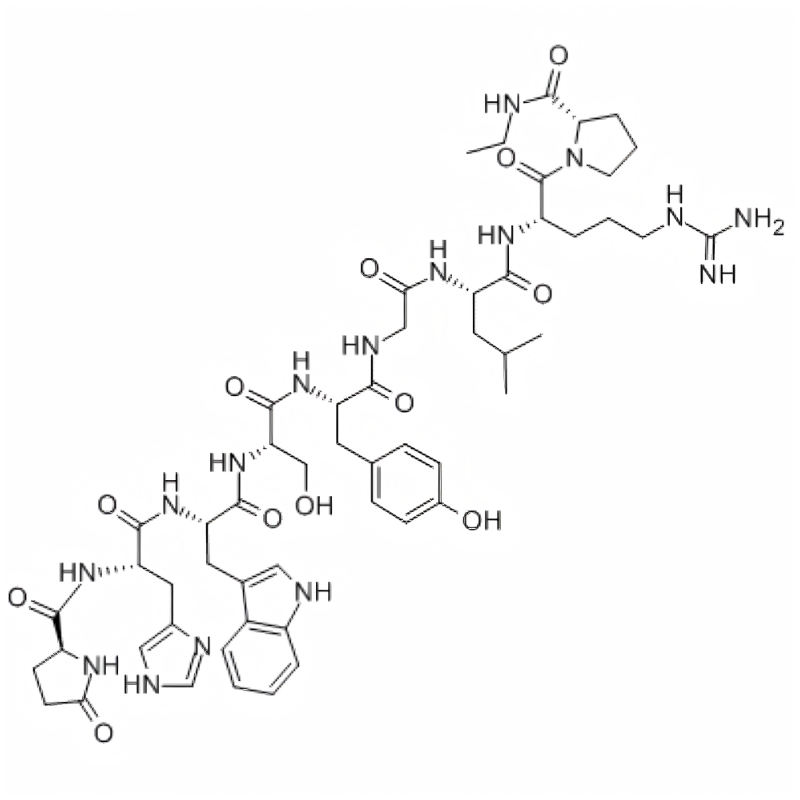
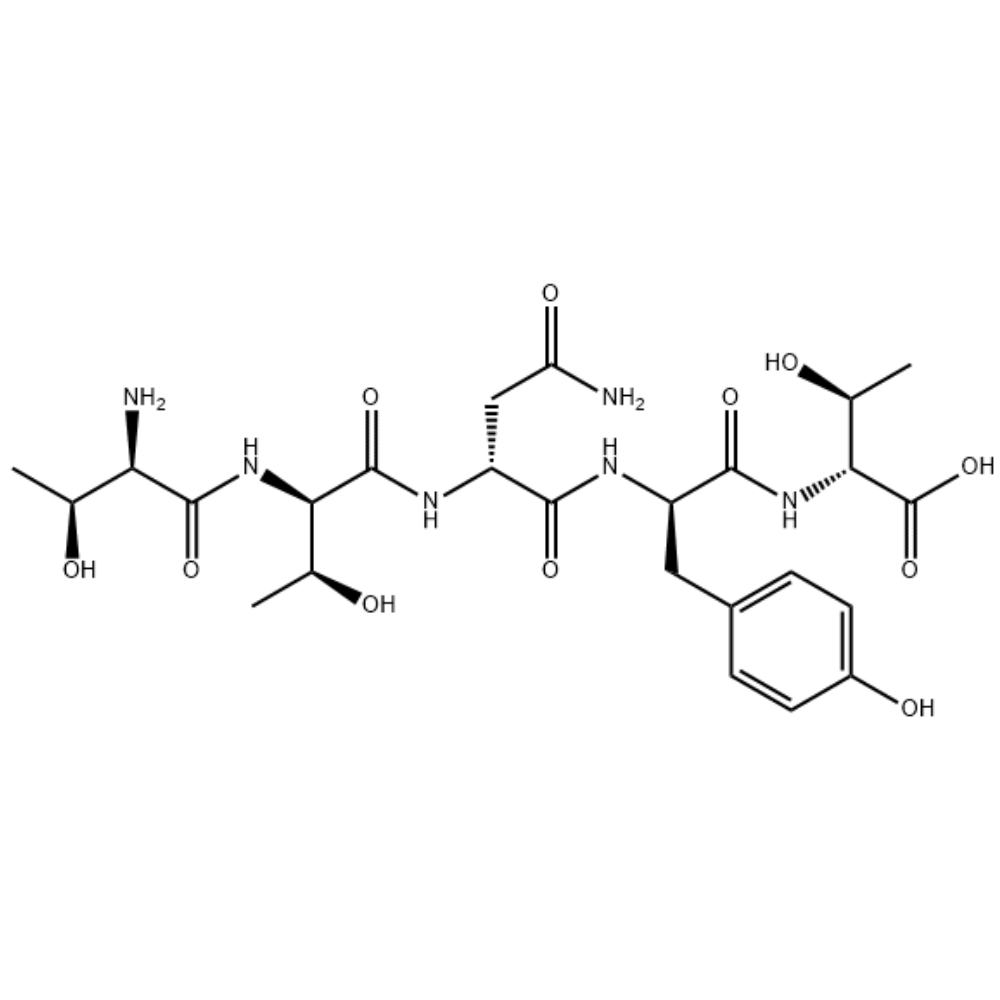
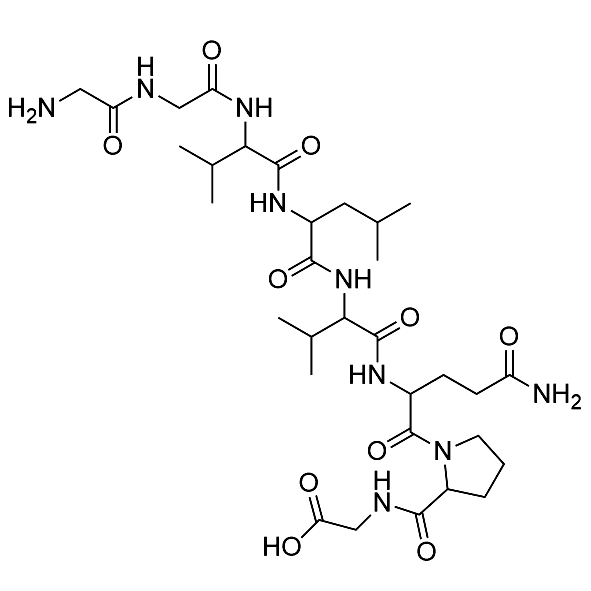
Acétate de fertireline/106756-71-2/Fabricant de peptides
Description
Fertirelin est un analogue puissant de l'hormone naturelle de libération des gonadotrophines (GnRH), principalement utilisée dans le domaine de la médecine vétérinaire. Il peut être utilisé pour traiter les kystes folliculaires ovariens chez les vaches et constitue le traitement préféré pour inverser ces kystes.
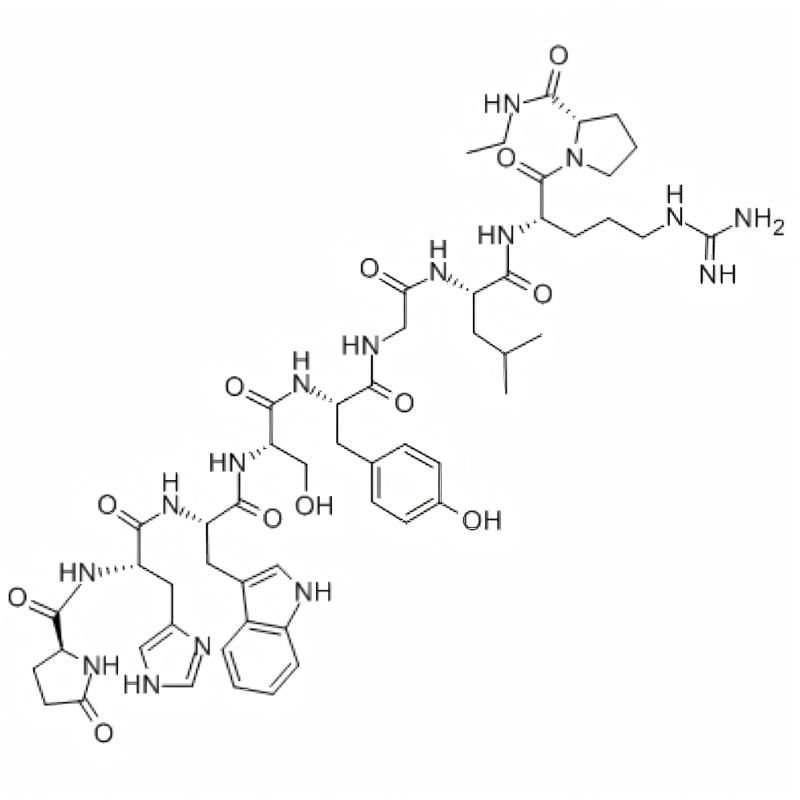
Caractéristiques
Apperance: poudre blanche à blanc cassé
Pureté (HPLC): ≥98,0%
Impureté unique: ≤ 2,0%
Contenu en acétate (HPLC): 5,0% ~ 12,0%
Contenu en eau (Karl Fischer): ≤ 10,0%
Contenu du peptide: ≥80,0%
Emballage et expédition: basse température, emballage à vide, précis à MG au besoin.
FAQ:
Quel emballage est utilisé pour mes marchandises ?
Nous utilisons généralement des bouteilles en PP pour l'emballage, puis recouvrons les bouteilles d'une couche de sacs en papier d'aluminium.
Quelle est la direction de la synthèse peptidique ?
La synthèse peptidique commence de l'extrémité C à l'extrémité N du peptide.
Comment les marchandises sont-elles transportées ?
Pour vos marchandises, nous confierons à DHL(DHL Express) ou à d'autres sociétés de transport le soin de gérer l'expédition.
Comment sont calculés les frais de livraison ?
Pour différents pays, les frais d'expédition varient et cela dépend de votre emplacement.